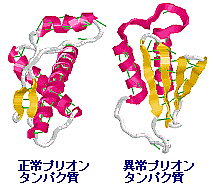
→ Webニュース情報へジャンプ ‖ プリオンタンパク質の構造例 ←
|
羊のプリオン病、人にも感染可能性 国際研究チーム(朝日,2014/12/17) [NEW!] → Jmolトピックス 重症急性呼吸器症候群(SARS)関連情報 | 鳥インフルエンザ情報 | HIVとエイズ ※食品以外も含めて他の感染関連のニュースはこちら ※『情報の入出力を基本とした食の安全教育と「食育」』(教職研修 2005年11月号掲載)を転載 ※新刊「プリオン説はほんとうか?」(福岡伸一,講談社ブルーバックス)を読むための参考資料作成 |
※その他のPDBデータ例
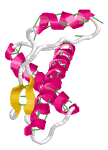
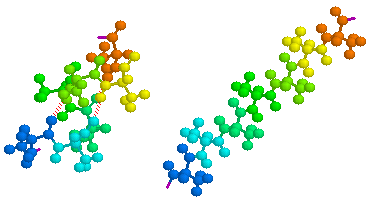
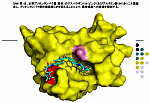
図1 PDBで参照できるHuman Prion Proteinの例(1QLX) … PDBデータ参照にはChimeが必要です(参考ページ)
※上のデータは2002年ノーベル化学賞を受賞したビュートリッヒ博士のグループによるものです! → 2002年度ノーベル化学賞
Human Prion Protein Variant M166V(1E1J) | Human Prion Protein Variant S170N(1E1S) | Bovine Prion Protein Residues 23-330(1DX0)
※Prusinerらによる抗プリオンのデータ例: The Anti-Prion Fab 3F4(1CR9) | The Anti-Prion Fab 3F4 In Complex With Its Peptide Epitope(1CU4)
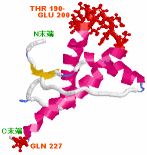
図2 Human Prion Protein例1QM2の基準振動解析で振動が大きいとされる部分
GLN 227 および THR 190-GLU 200(ただしNMR構造を拡張MM2力場で構造最適化後の解析) → 今週の分子(53)
※以下を参考に作成:日本化学会 編,「実験化学講座 第5版 12 計算化学」,pp.270-271,丸善(2004)